
25 câu trắc nghiệm Tốc độ phản ứng và cân bằng hóa học
- 30/11/2021
- 25 Câu hỏi
- 433 Lượt xem
Trắc Nghiệm Hay giới thiệu đến các bạn 25 câu trắc nghiệm Tốc độ phản ứng và cân bằng hóa học. Tài liệu bao gồm 25 câu hỏi kèm đáp án thuộc danh mục Chương 7: Tốc độ phản ứng và cân bằng hóa học. Tài liệu này sẽ giúp các bạn ôn tập, củng cố lại kiến thức để chuẩn bị cho các kỳ thi sắp tới. Mời các bạn tham khảo!
Cập nhật ngày
30/11/2021
Thời gian
20 Phút
Tham gia thi
0 Lần thi
Câu 1: Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào sau đây?
A. Tốc độ phản ứng.
B. Cân bằng hoá học.
C. Phản ứng một chiều.
D. Phản ứng thuận nghịch.
Câu 2: Hoàn thành phát biểu về tốc độ phản ứng sau:
"Tốc độ phản ứng được xác định bởi độ biến thiên ...(1)... của ...(2)... trong một đơn vị ...(3)..."
A. A. (1) nồng độ, (2) một trong các chất phản ứng hoặc sản phẩm, (3) thể tích.
B. B. (1) nồng độ, (2) một trong các chất phản ứng hoặc sản phẩm, (3) thời gian.
C. (1) thời gian, (2) một chất sản phẩm, (3) nồng độ.
D. D. (1) thời gian, (2) các chất phản ứng, (3) thể tích
Câu 4: Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây.
A. A. Thời gian xảy ra phản ứng.
B. B. Bề mặt tiếp xúc giữa các chất phản ứng.
C. C. Nồng độ các chất tham gia phản ứng.
D. D. Chất xúc tác.
Câu 5: Điền và hoàn thiện khái niệm về chất xúc tác sau.
"Chất xúc tác là chất làm ...(1)... tốc độ phản ứng nhưng ...(2)... trong quá trình phản ứng"
A. A. (1) thay đổi, (2) không bị tiêu hao.
B. (1) tăng, (2) không bị tiêu hao.
C. C. (1) tăng, (2) không bị thay đổi.
D. (1) thay, (2) bị tiêu hao không nhiều.
Câu 6: Đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng tăng là do
A. A. Nồng độ của các chất khí tăng lên.
B. B. Nồng độ của các chất khí giảm xuống.
C. C. Chuyển động của các chất khí tăng lên.
D. D. Nồng độ của các chất khí không thay đổi.
Câu 7: Phản ứng thuận nghịch là phản ứng
A. A. trong cùng điều kiện, phản ứng xảy ra theo hai chiều trái ngược nhau.
B. B. có phương trình hoá học được biểu diễn bằng mũi tên một chiều.
C. C. chỉ xảy ra theo một chiều nhất định.
D. D. xảy ra giữa hai chất khí.
Câu 8: Mối quan hệ giữa tốc độ phản ứng thuận vt và tốc độ phản ứng nghịch vn ở trạng thái cân bằng được biểu diễn như thế nào?
A. A. vt= 2vn.
B. vt=vn¹ 0
C. vt=0,5vn.
D. vt=vn=0
Câu 9: Sự dịch chuyển cân bằng hoá học là sự di chuyển từ trạng thái cân bằng hoá học này sang trạng thái cân bằng hoá học khác do
A. A. không cần có tác động của các yếu tố từ bên ngoài tác động lên cân bằng.
B. B. tác động của các yếu tố từ bên ngoài tác động lên cân bằng.
C. C. tác động của các yếu tố từ bên trong tác động lên cân bằng.
D. D. cân bằng hóa học tác động lên các yếu tố bên ngoài.
Câu 10: Các yếu tố ảnh hưởng đến cân bằng hoá học là .
A. A. nồng độ, nhiệt độ và chất xúc tác.
B. B. nồng độ, áp suất và diện tích bề mặt.
C. C. nồng độ, nhiệt độ và áp suất.
D. D. áp suất, nhiệt độ và chất xúc tác.
Câu 11: Cho cân bằng sau trong bình kín: 2NO2(màu nâu đỏ)N2O4 (không màu). Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có
A. ΔH < 0, phản ứng toả nhiệt
B. ΔH > 0, phản ứng toả nhiệt
C. ΔH < 0, phản ứng thu nhiệt
D. ΔH > 0, phản ứng thu nhiệt
Câu 12: Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố nào đã được sử dụng để làm tăng tốc độ phản ứng ?
A. A. Nhiệt độ, áp suất.
B. B. diện tích tiếp xúc.
C. C. Nồng độ.
D. D. xúc tác.
Câu 13: Thực hiện 2 thí nghiệm theo hình vẽ sau
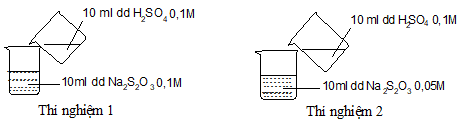
Ở thí nghiệm nào có kết tủa xuất hiện trước?

A. A. TN1 có kết tủa xuất hiện trước.
B. B. TN2 có kết tủa xuất hiện trước.
C. C. Kết tủa xuất hiện đồng thời.
D. D. Không có kết tủa xuất hiện
Câu 14: So sánh tốc độ của 2 phản ứng sau (thực hiện ở cùng nhiệt độ, khối lượng Zn sử dụng là như nhau) .
Zn (bột) + dung dịch CuSO4 1M (1)
Zn (hạt) + dung dịch CuSO4 1M (2)
Kết quả thu được là .
A. A. (1) nhanh hơn (2).
B. B. (2) nhanh hơn (1).
C. C. như nhau.
D. D. ban đầu như nhau, sau đó (2) nhanh hơn(1)
Câu 15: Khi cho cùng một lượng nhôm vào cốc đựng dung dịch axit HCl 0,1M, tốc độ phản ứng sẽ lớn nhất khi dùng nhôm ở dạng nào sau đây ?
A. A. Dạng viên nhỏ.
B. B. Dạng bột mịn, khuấy đều.
C. C. Dạng tấm mỏng.
D. D. Dạng nhôm dây
Câu 16: Yếu tố nào dưới đây được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín để ủ ancol (rượu) ?
A. A. Chất xúc tác.
B. B. áp suất.
C. C. Nồng độ
D. D. Nhiệt độ.
Câu 17: Trong gia đình, nồi áp suất được sử dụng để nấu chín kỹ thức ăn. Lí do nào sau đây không đúng khi giải thích cho việc sử dụng nồi áp suất ?
A. A. Tăng áp suất và nhiệt độ lên thức ăn.
B. Giảm hao phí năng lượng.
C. C. Giảm thời gian nấu ăn.
D. D. Tăng diện tích tiếp xúc thức ăn và gia vị
Câu 18: Khi cho axit clohiđric tác dụng với kali pemanganat (rắn) để điều chế clo, khí clo sẽ thoát ra nhanh hơn khi dùng
A. A. axit clohiđric đặc và đun nhẹ hỗn hợp.
B. B. axit clohiđric đặc và làm lạnh hỗn hợp.
C. C. axit clohiđric loãng và đun nhẹ hỗn hợp.
D. D. axit clohiđric loãng và làm lạnh hỗn hợp
Câu 19: Cho phản ứng phân huỷ hiđro peoxit trong dung dịch .
2H2O2 2H2O + O2
Yếu tố ảnh không hưởng đến tốc độ phản ứng là .
A. A. Nồng độ H2O2.
B. Thời gian
C. C. Nhiệt độ.
D. D. Chất xúc tác MnO2
Câu 20: Trong phòng thí nghiệm, có thể điều chế khí oxi từ muối kali clorat. Người ta sử dụng cách nào sau đây nhằm mục đích tăng tốc độ phản ứng ?
A. Nung kaliclorat ở nhiệt độ cao.
B. B. Nung hỗn hợp kali clorat và mangan đioxit ở nhiệt độ cao.
C. C. Dùng phương pháp dời nước để thu khí oxi.
D. D. Dùng phương pháp dời không khí để thu khí oxi.
Câu 21: Cho 2 mẫu BaSO3 có khối lượng bằng nhau và 2 cốc chứa 50ml dung dịch HCl 0,1M như hình sau. Hỏi ở cốc nào mẫu BaSO3 tan nhanh hơn?
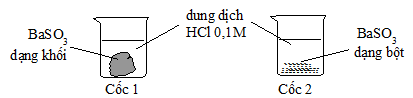

A. A. Cốc 1 tan nhanh hơn.
B. B. Cốc 2 tan nhanh hơn.
C. C. Tốc độ tan ở 2 cốc như nhau.
D. D. BaSO3 tan nhanh nên không quan sát được.
Câu 22: Có 3 cốc chứa 20ml dung dịch H2O2 cùng nồng độ. Tiến hành 3 thí nghiệm như hình vẽ sau.
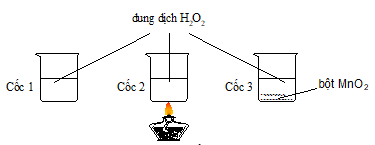
Ở thí nghiệm nào có bọt khí thoát ra chậm nhất?

A. A. Thí nghiệm1
B. B. Thí nghiệm 2
C. C. Thí nghiệm 3
D. D. 3 thí nghiệm như nhau
Câu 23: Cho phản ứng: 2KClO3 (r) 2KCl(r) + 3O2 (k). Yếu tố không ảnh hưởng đến tốc độ của phản ứng trên là
A. A. Kích thước các tinh thể KClO3.
B. B. Áp suất.
C. C. Chất xúc tác.
D. D. Nhiệt độ
Câu 24: Cho cân bằng hoá học: N2(k) + 3H2 (k) 2NH3 (k). Phản ứng thuận là phản ứng toả nhiệt. Cân bằng hoá học không bị chuyển dịch khi
A. thay đổi áp suất của hệ.
B. thay đổi nồng độ N2.
C. thay đổi nhiệt độ.
D. thêm chất xúc tác Fe
Câu 25: Ở cùng một nồng độ, phản ứng nào dưới đây có tốc độ phản ứng xảy ra chậm nhất
A. A. Al + dd NaOH ở 25oC
B. B. Al + dd NaOH ở 30oC
C. C. Al + dd NaOH ở 40oC
D. D. Al + dd NaOH ở 50oC
Cùng danh mục Chương 7: Tốc độ phản ứng và cân bằng hóa học
- 414
- 1
- 13
-
13 người đang thi
- 455
- 0
- 25
-
54 người đang thi
- 345
- 0
- 3
-
93 người đang thi
- 421
- 0
- 15
-
90 người đang thi
Chia sẻ:
Đăng Nhập để viết bình luận