Câu hỏi: Chọn phương án đúng. Cho quá trình điện cực: 3Fe3+(dd) + 4H2O(ℓ) + 1e → Fe3O4(r) + 8H+(dd). Phương trình Nerst đối với quá trình đã cho ở 250C có dạng:
A. \(\varphi = {\varphi ^0} + 0.059\lg \frac{{{{\left[ {{H^ + }} \right]}^8}}}{{{{\left[ {F{e^{3 + }}} \right]}^3}{{\left[ {{H_2}O} \right]}^4}}}\)
B. \(\varphi = {\varphi ^0} + 0.059\lg \frac{{{{\left[ {{H^ + }} \right]}^8}}}{{{{\left[ {F{e^{3 + }}} \right]}^3}}}\)
C. \(\varphi = {\varphi ^0} + 0.059\lg \frac{{{{\left[ {F{e^{3 + }}} \right]}^3}}}{{{{\left[ {{H^ + }} \right]}^8}}}\)
D. \(\varphi = {\varphi ^0} + 0.059\lg \frac{{{{\left[ {F{e^{3 + }}} \right]}^3}{{\left[ {{H_2}O} \right]}^4}}}{{\left[ {F{e_3}{O_4}} \right]{{\left[ {{H^ + }} \right]}^8}}}\)
Câu 1: Chọn trường hợp đúng. Quá trình đông đặc nước đá ở -1°C và 1 atm có:
A. DS < 0, DH < 0, DG < 0
B. DS < 0, DH < 0, DG > 0
C. DS < 0, DH > 0, DG < 0
D. DS >0, DH < 0, DG < 0
30/08/2021 1 Lượt xem
Câu 2: Chọn phương án đúng: Cho phản ứng: C6H6 + \frac{{15}}{2} O2(k) ® 6CO2(k) + 3H2O. Ở 270C phản ứng có ∆H – ∆U = 3741,3 J. Hỏi C6H6 và H2O trong phản ứng ở trạng thái lỏng hay khí? Cho biết R = 8,314 J/mol.K.
A. C6H6(k) và H2O(ℓ)
B. C6H6(k) và H2O(k)
C. C6H6(ℓ) và H2O(k)
D. C6H6(ℓ) và H2O(ℓ)
30/08/2021 2 Lượt xem
Câu 3: Chọn phát biểu đúng. Thiết lập biểu thức ∆G của phản ứng sau ở 25oC. 2 Hg (ℓ) + O2 (k) ⇄ 2HgO (tinh thể):
A. \(\Delta {G_{298}} = \Delta G_{25}^0 + 25.R.\ln \frac{1}{{{P_{{O_2}}}}}\)
B. \(\Delta {G_{298}} = \Delta G_{298}^0 - 298.R.\ln {P_{{O_2}}}\)
C. \(\Delta {G_{298}} = \Delta G_{298}^0 + 298.R.\ln \frac{{{{\left[ {HgO} \right]}^2}}}{{{{\left[ {Hg} \right]}^2}\left[ {{O_2}} \right]}}\)
D. \(\Delta {G_{298}} = \Delta G_{298}^0 + 298.R.\ln \frac{{{{\left[ {HgO} \right]}^2}}}{{{{\left[ {Hg} \right]}^2}{P_{{O_2}}}}}\)
30/08/2021 1 Lượt xem
Câu 4: Chọn phương án đúng: Trong 200g dung môi chứa A g đường glucô có khối lượng phân tử M; hằng số nghiệm đông của dung môi là Kđ. Hỏi biểu thức nào đúng đối với DTđ:
A. \(\Delta {T_d} = {k_d}A\)
B. \(\Delta {T_d} = \frac{{{k_d}A}}{M}\)
C. \(\Delta {T_d} = \frac{{{k_d}A}}{{5M}}\)
D. \(\Delta {T_d} = \frac{{5{k_d}A}}{M}\)
30/08/2021 1 Lượt xem
Câu 5: Chọn phương án đúng: Cho giản đồ hòa tan như hình sau: 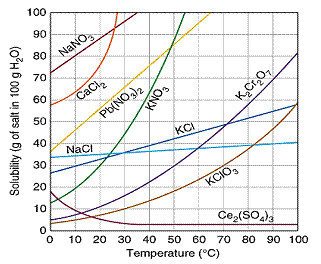
A. Không đủ cơ sở để xác định
B. Dung dịch chưa bão hòa
C. Dung dịch bão hòa
D. Dung dịch quá bão hòa
30/08/2021 2 Lượt xem
Câu 6: Tính công dãn nở khi cho 10mol CH3CHOHCH3 vào bình chân không, phân ly ở 177oC theo phản ứng sau: CH3CHOHCH3 (k) ⇄ CH3COCH3 (k) + H2 (k). Cho biết R = 8,314 J/mol.K, xem các khí trong phản ứng là khí lý tưởng.
A. 3,741 J
B. 37,41 J
C. 1,47 J
D. 14,72 J
30/08/2021 1 Lượt xem

Câu hỏi trong đề: Bộ câu hỏi trắc nghiệm môn Hóa học đại cương - Phần 10
- 1 Lượt thi
- 50 Phút
- 45 Câu hỏi
- Sinh viên
Cùng chủ đề Bộ câu hỏi trắc nghiệm môn Hóa học đại cương có đáp án
- 644
- 19
- 45
-
80 người đang thi
- 665
- 3
- 45
-
79 người đang thi
- 659
- 7
- 45
-
38 người đang thi
- 613
- 2
- 45
-
80 người đang thi




Chia sẻ:
Đăng Nhập để viết bình luận